0 引言
1 材料与方法
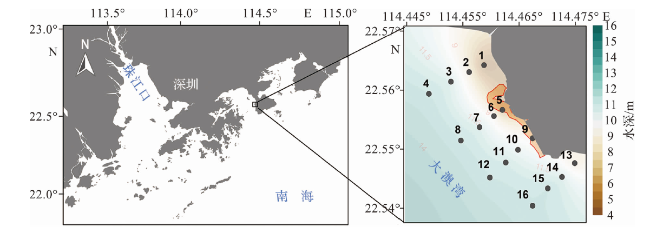
1.1 研究区域概况
1.2 样品采集与分析方法
1.3 室内培养实验
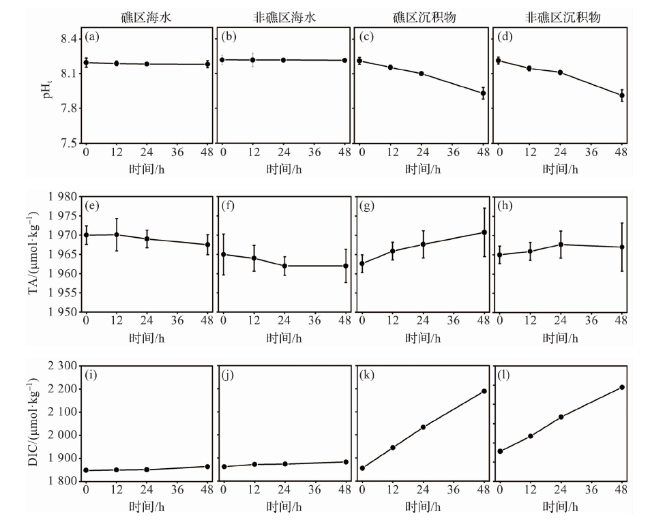
1.3.1 海水及沉积物培养实验
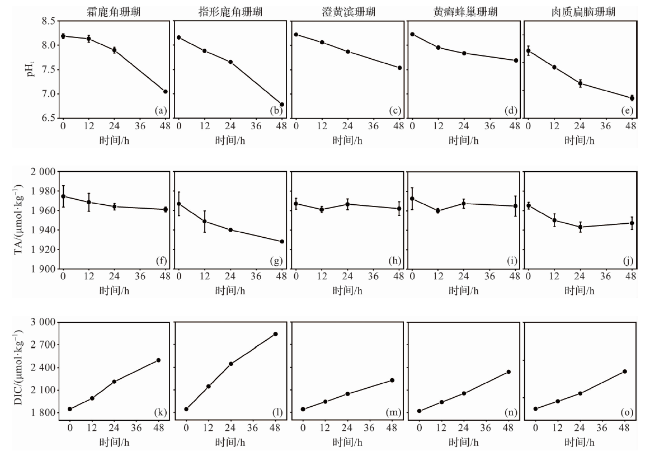
1.3.2 珊瑚代谢实验
1.4 海-气界面CO2通量计算
2 结果
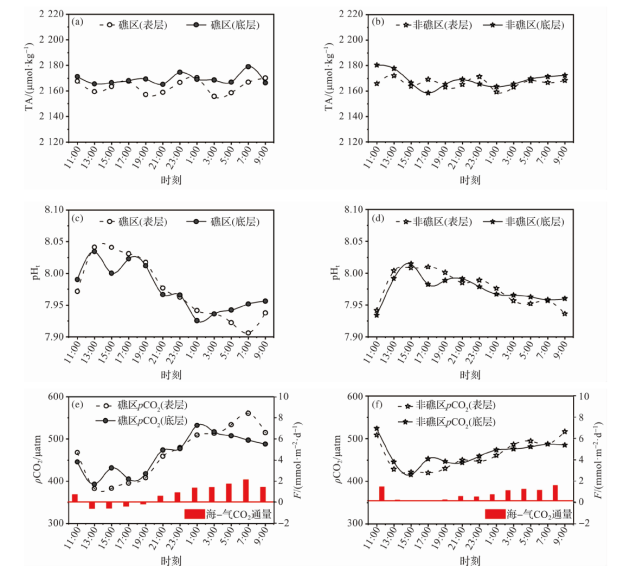
2.1 海上调查结果
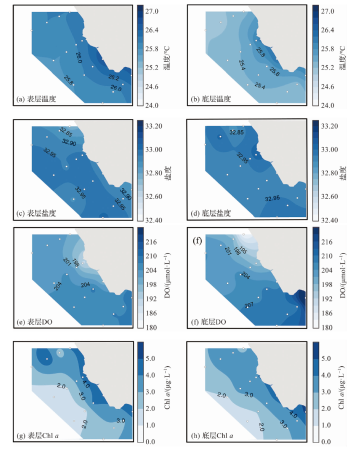
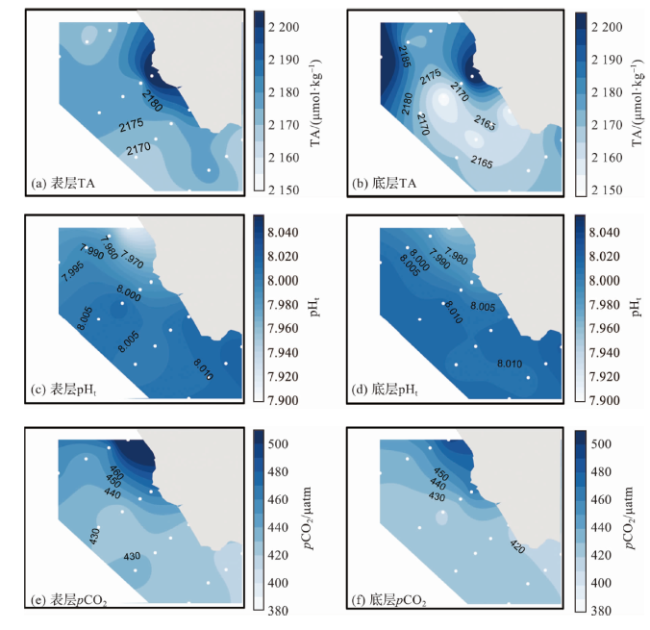
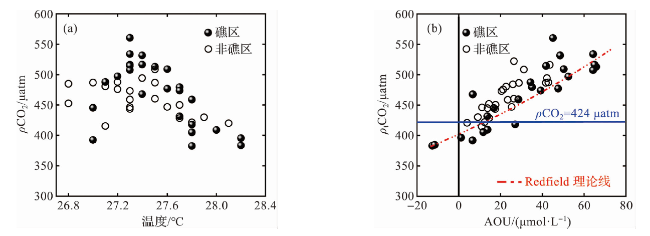
2.1.1 海水p(CO2)相关参数的空间分布
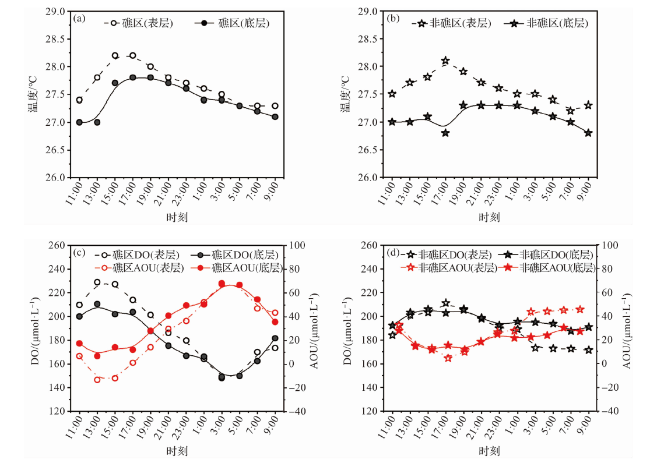
2.1.2 海水pCO2相关参数的日周期变化
2.2 室内培养实验结果
图6 室内模拟实验中pHt、TA和DIC的变化(珊瑚代谢)Fig.6 Changes in pHt, TA, and DIC during indoor simulation experiments (coral metabolism) |
图7 室内模拟实验中pHt、TA和DIC的变化(海水和沉积物微生物代谢)Fig.7 Changes in pHt, TA and DIC during indoor simulation experiments (microbial metabolism in seawater and sediment) |
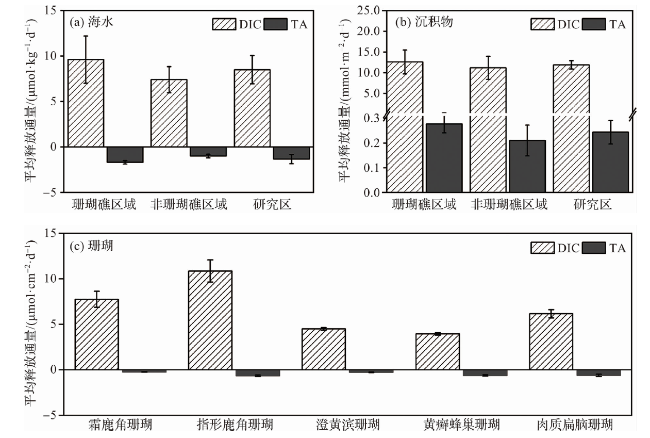
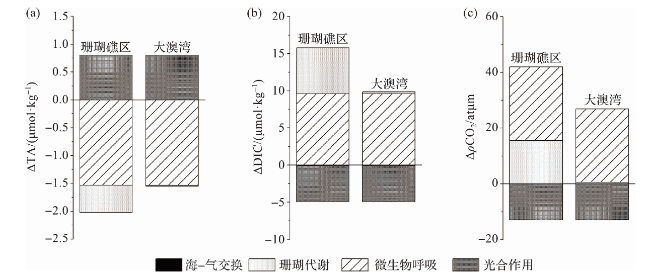
图8 海水微生物代谢、沉积物释放以及珊瑚代谢过程中DIC和TA的平均释放通量Fig.8 The average release fluxes of DIC and TA during the seawater microbial metabolism, sediment release, and the coral metabolism |
表1 全球近海/河口区海水微生物代谢、沉积物释放和珊瑚代谢过程中DIC和TA的释放通量Tab.1 The release fluxes of DIC and TA during the seawater microbial metabolism, sediment release, and the coral metabolism in other offshore/estuarine areas of the world |
| 项目 | 释放通量 | 研究区域(目标) | 数据来源 | |
|---|---|---|---|---|
| DIC | TA | |||
| 海水微生物代谢 /(μmol·kg-1·d-1) | 13.01±2.95 | -1.40±0.36 | 胶州湾(海水) | 文献[29] |
| 4.95±0.41 | 路易斯安那大陆架(海水) | 文献[30] | ||
| 14.21±1.31 | 墨西哥湾(海水) | 文献[31] | ||
| 沉积物释放 /(mmol·m-2·d-1) | 6.05±1.58 | 北黄海(沉积物) | 文献[32] | |
| 6.94±4.90 | 南黄海(沉积物) | 文献[33] | ||
| 0.82±0.02 | 博滕海(沉积物) | 文献[34] | ||
| 2.12±0.07 | 博恩霍尔姆岛沿岸(沉积物) | 文献[34] | ||
| 9.32±3.52 | 英国北海(沉积物) | 文献[35] | ||
| 31.14±22.01 | 29.06±21.39 | 墨西哥湾(沉积物) | 文献[31] | |
| 9.70±2.88 | 3.84±2.77 | 蒙特利湾(沉积物) | 文献[36] | |
| 17.23±1.70 | 路易斯安那大陆架(沉积物) | 文献[37] | ||
| 珊瑚代谢 /(mmol·cm-2·d-1) | -27.12±2.33 | 指形鹿角珊瑚 | 文献[38] | |
| -16.60±0.70 | 美丽鹿角珊瑚 | 文献[39] | ||
| -54 | 铁星珊瑚 | 文献[40] | ||
| -0.38±1.26 | 板叶角蜂巢珊瑚 | 文献[41] | ||
| 13.82 | 风信子鹿角珊瑚 | 文献[42] | ||
| 0.53 | 丛生盔形珊瑚 | 文献[42] | ||
注:释放通量的正值和负值分别表示释放和吸收。 |
3 讨论
3.1 春季大澳湾pCO2空间分布的影响因素分析
表2 大澳湾表、底层海水中pCO2与环境因子的相关性(n=16)Tab.2 Correlation between pCO2 and environmental factors in the surface and bottom waters of Daao Bay (n=16) |
| 层位 | 温度 | 盐度 | AOU | Chl a |
|---|---|---|---|---|
| 表层 | -0.111 | -0.596* | 0.476* | 0.225 |
| 底层 | -0.088 | 0.200 | 0.826** | -0.069 |
注:*表示0.01<p<0.05,**表示 p<0.01。 |
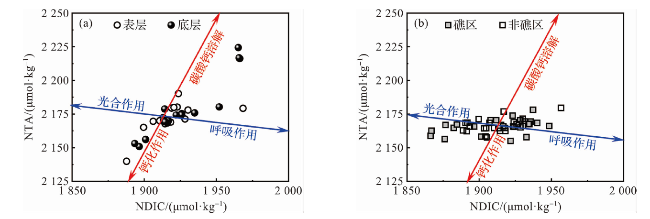
图9 不同调查站位(a)和24 h定点连续观测站位(b)海水中NTA和NDIC的关系(红色线和蓝色线的交点为海水样本NTA和NDIC的平均值。) Fig.9 The relationship between NTA and NDIC of seawater in different survey stations (a) and 24 h fixed-point continuous observation stations (b) (The intersection of the red and blue line is the average of NTA and NDIC for seawater samples.) |