0 引言
1 数据和方法
1.1 数据来源
1.2 数据处理
1.2.1 聚类分析与集合分析
1.2.2 特有性简约分析
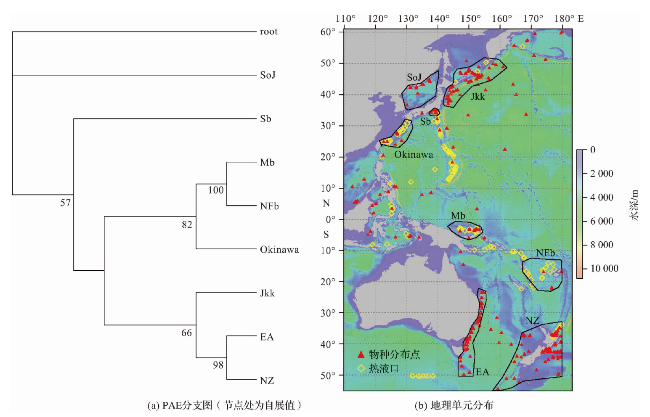
2 结果
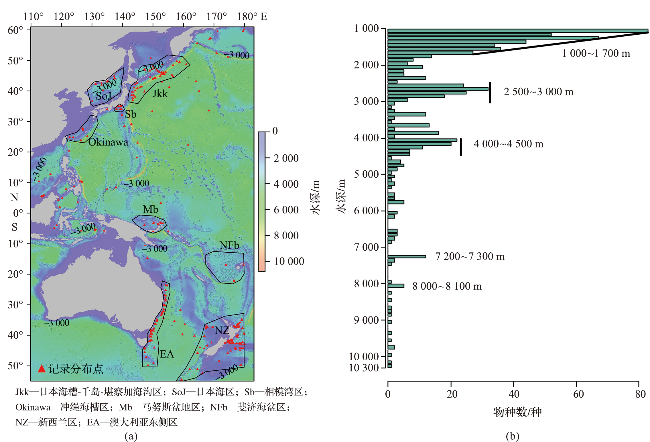
2.1 物种分布特征
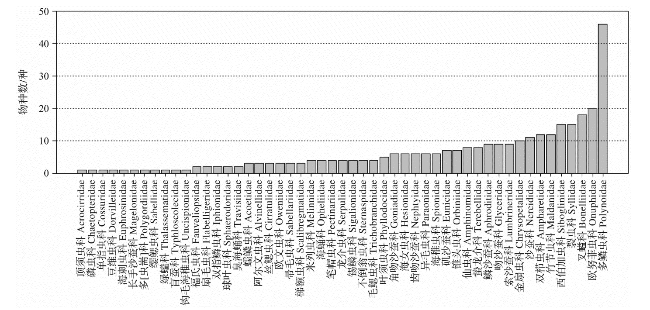
表1 西太平洋深海底栖多毛类记录数前10个科Tab.1 The top 10 deep-sea benthic polychaete families with the most records in the western Pacific |
| 序号 | 科名 | 记录数 | 分布水深/m |
|---|---|---|---|
| 1 | 阿尔文虫科Alvinellidae | 247 | 1 002~3 600 |
| 2 | 多鳞虫科Polynoidae | 141 | 1 000~12 000 |
| 3 | 鳞沙蚕科Aphroditidae | 99 | 1 000~4 800 |
| 4 | 米列虫科Melinnidae | 96 | 1 005~2 821 |
| 5 | 叉螠科Bonelliidae | 86 | 1 088~9 950 |
| 6 | 欧努菲虫科Onuphidae | 83 | 1 000~4 744 |
| 7 | 双栉虫科Ampharetidae | 81 | 1 028~5 613 |
| 8 | 竹节虫科Maldanidae | 65 | 1 005~7 290 |
| 9 | 西伯加虫科Siboglinidae | 55 | 1 053~9 600 |
| 10 | 仙虫科Amphinomidae | 44 | 1 013~4 200 |
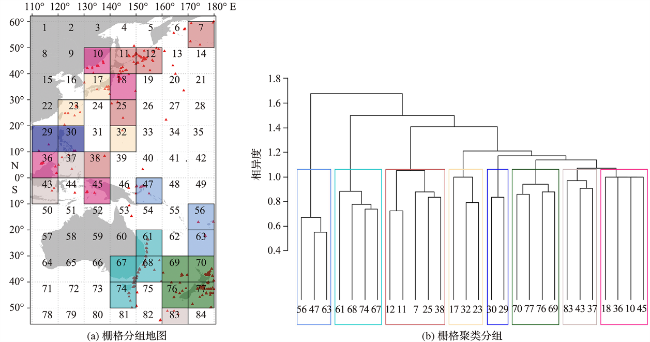
2.2 聚类及集合分析
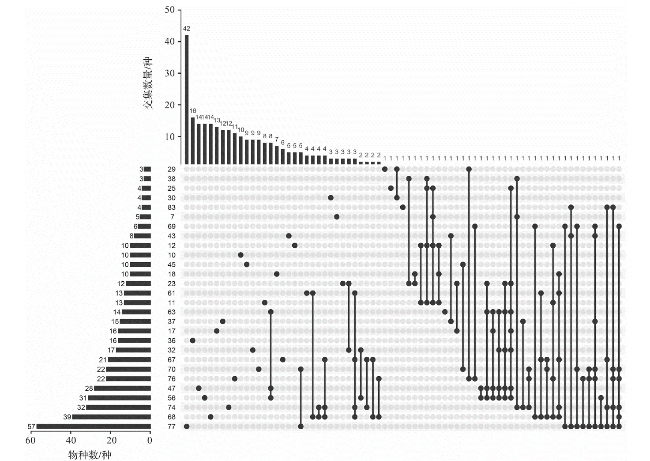
图4 栅格物种集合分析图(左侧柱状图:栅格的物种数;上方柱状图:交集数量,表示共有或特有的物种数量;点图矩阵:不同栅格的交集,矩阵左侧数字为栅格编号;单独实心黑点:每个栅格特有的物种数量;实心黑点与连线:不同栅格间的共有物种。) Fig.4 Upset plot showing intersections of different grids (left bar chart: species richness in each grids; upper bar chart: intersection size showing number of shared or endemic species; points matrix: intersection of grids, the numbers on the left of the matrix represent the number of grid; black solid circle: number of species unique to each grid; solid circle and lines: shared species between different grids.) |