0 引言
1 材料与方法
1.1 幼苗来源及培养条件
1.2 实验设计
1.3 海水碳酸盐系统参数的测定
1.4 相对生长速率的测定和计算
1.5 叶绿素荧光参数的测定和计算
1.6 呼吸速率和净光合速率的测定和计算
1.7 色素的测定和计算
1.8 数据统计及分析
2 结果与分析
2.1 CO2和DIP对海水碳酸盐系统的影响
表1 不同处理组的海水碳酸盐系统参数Tab.1 Parameters of seawater carbonate system under different treatments |
| 处理组 | pH | pCO2/μatm | DIC/(μmol·kg-1) | HC /(μmol·kg-1) | C /(μmol·kg-1) | CO2/(μmol·kg-1) | TA/(μmol·kg-1) |
|---|---|---|---|---|---|---|---|
| LCLP | 8.20±0.01a | 382.36±13.07a | 2 002.85±19.95a | 1 817.53±21.22a | 172.70±2.17a | 12.26±0.43a | 2 251.60±16.65a |
| LCMP | 8.18±0.02a | 408.82±24.69a | 2 036.32±33.82a | 1 854.54±36.41a | 168.29±3.41a | 13.49±0.81a | 2 276.87±27.12a |
| LCHP | 8.19±0.02a | 395.95±20.66a | 2 022.36±37.76a | 1 838.52±36.85a | 170.77±5.93a | 13.07±0.68a | 2 267.25±38.27a |
| HCLP | 7.85±0.00b | 931.28±15.51b | 2 092.77±34.85b | 1 978.08±32.94b | 83.96±1.40b | 30.73±0.51b | 2 194.97±35.74a |
| HCMP | 7.86±0.01b | 908.84±38.05b | 2 106.87±46.75ab | 1 989.78±44.75b | 87.09±2.30b | 30.00±1.26b | 2 214.06±46.52a |
| HCHP | 7.85±0.03b | 940.03±44.52b | 2 111.23±37.31b | 1 995.36±32.66b | 84.84±6.29b | 31.02±1.47b | 2 214.06±46.52a |
注:不同字母表示不同处理组间差异显著(p<0.05)。 |
2.2 CO2和DIP对相对生长速率的影响
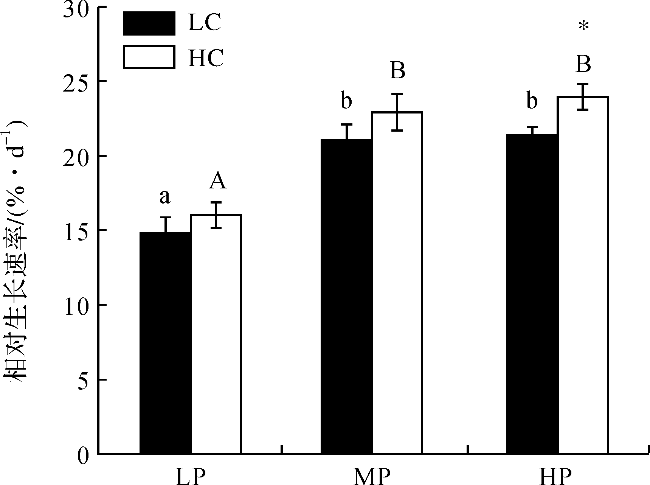
图1 不同处理下浒苔幼苗的相对生长速率(不同小写字母表示在LC条件下不同处理组间差异显著,p<0.05;不同大写字母表示在HC条件下不同处理组间差异显著,p<0.05;*表示同一DIP浓度下不同CO2处理组间差异显著,p<0.05。) Fig.1 Relative growth rate of U.prolifera seedlings under different treatments (Different lowercase letters represent significant differences among different treatments under LC, p<0.05), and different capital letters represent significant differences among different treatments under HC, p<0.05; Asterisk represents significant differences between LC and HC within a DIP treatment,p<0.05.) |
2.3 CO2和DIP对荧光参数的影响
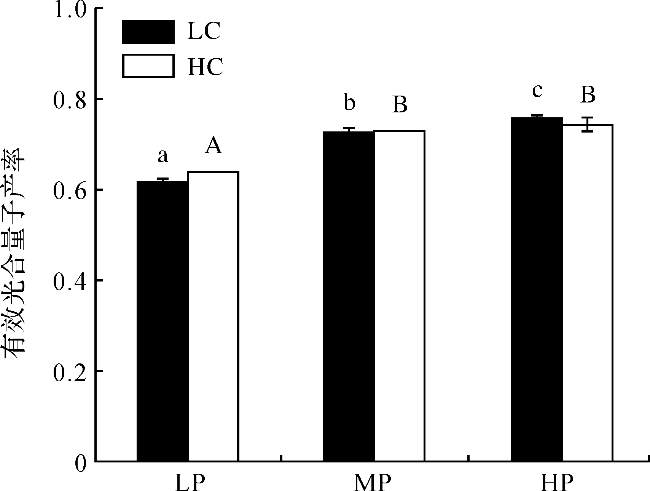
图2 不同处理下浒苔幼苗的有效光合量子产率(不同小写字母表示在LC条件下不同处理组间差异显著, p<0.05;不同大写字母表示在HC条件下不同处理组间差异显著, p<0.05。) Fig.2 Effective quantum yield of U.prolifera seedlings under different treatments (Different lowercase letters represent significant differences among different treatments under LC, p<0.05), and different capital letters represent significant differences among different treatments under HC, p<0.05.) |
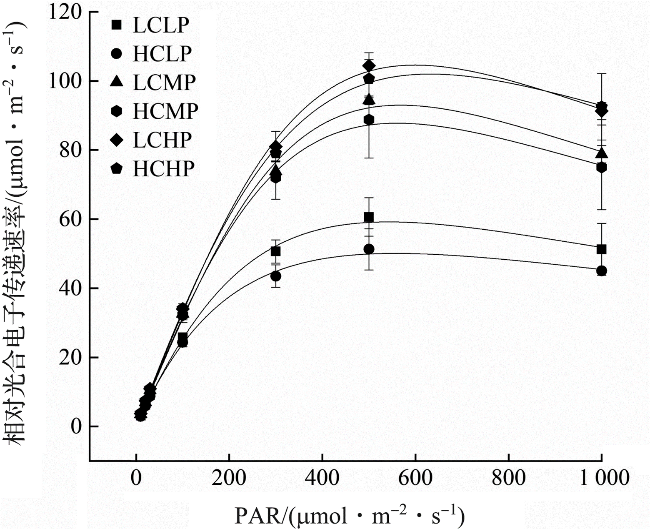
图3 不同PAR下浒苔幼苗的相对光合电子传递速率Fig.3 Relative electron transfer rate of U.prolifera seedlings under different PAR |
表2 不同处理下浒苔幼苗的最大相对光合电子传递速率(rETRmax)、光能利用效率(α)与饱和光强(Ek)Tab.2 The maximum rETR (rETRmax), light utilization efficiency (α) and saturation light intensity (Ek) of U.prolifera seedlings under different treatments |
| 处理组 | 最大相对光合电子传递速率 (rETRmax)/(μmol·m-2·s-1) | 光能利用 效率(α) | 饱和光强(Ek)/ (μmol·m-2·s-1) |
|---|---|---|---|
| LCLP | 61.89±3.12a | 0.29±0.02a | 211.38±6.35a |
| LCMP | 92.63±1.93b | 0.31±0.02ab | 302.23±23.16b |
| LCHP | 105.88±2.93c | 0.33±0.02b | 317.11±13.97b |
| HCLP | 48.39±1.28A* | 0.32±0.02A | 153.20±11.79A* |
| HCMP | 92.63±7.87B | 0.34±0.01A | 274.33±15.32B |
| HCHP | 104.79±6.13B | 0.35±0.03A | 303.19±38.09B |
注:不同小写字母表示在LC条件下不同处理组间差异显著(p<0.05),不同大写字母表示在HC条件下不同处理组间差异显著(p<0.05);*表示同一DIP浓度下不同CO2水平处理组间差异显著(p<0.05)。 |
2.4 CO2和DIP对净光合速率和呼吸速率的影响
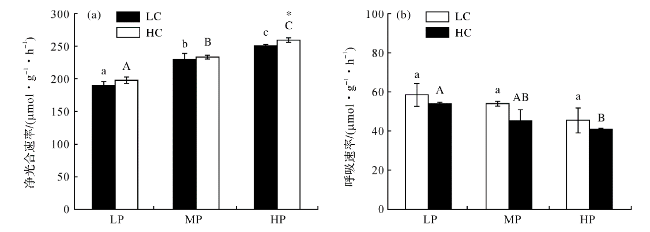
图4 不同处理下浒苔幼苗的净光合速率(a)和呼吸速率(b)(不同小写字母表示在LC条件下不同处理组间差异显著,p<0.05;不同大写字母表示在HC条件下不同处理组间差异显著,p<0.05;*表示同一DIP浓度下不同CO2处理组间差异显著,p<0.05。) Fig.4 Net photosynthetic rate (a) and respiration rate (b) of U.prolifera seedlings under different treatments (Different lowercase letters represent significant differences among different treatments under LC, p<0.05, and different capital letters represent significant differences among different treatments under HC, p<0.05; Asterisk represents significant differences between LC and HC within a DIP treatment, p<0.05.) |
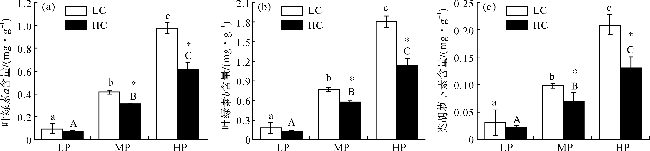
2.5 CO2和DIP对色素的影响
图5 不同处理下浒苔幼苗的叶绿素a(a)、叶绿素b(b)与类胡萝卜素(c)含量(不同小写字母表示在LC条件下不同处理组间差异显著,p<0.05;不同大写字母表示在HC条件下不同处理组间差异显著,p<0.05;*表示同一DIP浓度下不同CO2处理组间差异显著,p<0.05。) Fig.5 The contents of chlorophyll a (a), chlorophyll b (b) and carotenoids (c) contents in U.prolifera seedlings under different treatments (Different lowercase letters represent significant differences among different treatments under LC, p<0.05, and different capital letters represent significant differences among different treatments under HC, p<0.05; Asterisk represents significant differences between LC and HC within a DIP treatment, p<0.05.) |