0 引言
1 材料与方法
1.1 研究区域概况
1.2 样品采集与处理
1.3 数据分析
1.3.1 大型底栖动物群落结构分析
1.3.2 大型底栖动物功能群划分与生态系统健康评估
1.3.3 碳库计算
2 结果与分析
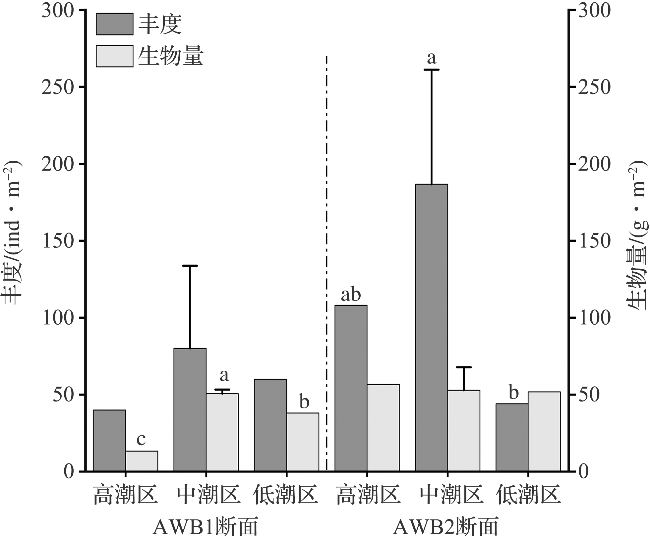
2.1 大型底栖动物群落分析
表1 隘顽湾大型底栖动物的功能群、类群和物种分布Tab.1 Distribution of functional groups, taxa and species of macrobenthos in Aiwan Bay |
| 功能群 | 类群 | 物种 | AWB1断面 | AWB2断面 | |||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| 高潮区 | 中潮区 | 低潮区 | 高潮区 | 中潮区 | 低潮区 | ||||||
| 肉食者 | 多毛类动物 | 寡鳃齿吻沙蚕 | Nephtys oligobranchia | + | + | ||||||
| 索沙蚕属 | Lumbrineris sp. | + | + | ||||||||
| 长吻沙蚕 | Glycera chirori | + | + | + | |||||||
| 甲壳类动物 | 鲜明鼓虾 | Alpheusdistinguendus | + | + | |||||||
| 软体动物 | 斑玉螺 | Naticatigrina | + | ||||||||
| 半褶织纹螺 | Nassarius semiplicatus | + | + | + | + | ||||||
| 秀丽织纹螺 | Reticunassa festiva | + | |||||||||
| 其他类动物 | 红狼牙虾虎鱼 | Odontamblyopus rubicundus | + | + | |||||||
| 纽虫 | Nemertinea sp. | + | |||||||||
| 浮游生物食者 | 软体动物 | 彩虹明樱蛤 | Iridona iridescens | + | |||||||
| 短拟沼螺 | Assiminea brevicula | + | + | + | + | + | |||||
| 金星蝶铰蛤 | Trigonothracia jinxingae | + | |||||||||
| 婆罗囊螺 | Semiretusa borneensis | + | + | + | |||||||
| 青蛤 | Cyclina sinensis | + | |||||||||
| 小荚蛏 | Siliqua minima | + | |||||||||
| 缢蛏 | Sinonovacula constricta | + | + | + | + | ||||||
| 植食者 | 甲壳类动物 | 淡水泥蟹 | Ilyoplax tansuiensis | + | + | ||||||
| 弧边招潮 | Tubuca arcuata | + | + | + | |||||||
| 隆线拳蟹 | Philyracarinata | + | + | + | |||||||
| 日本大眼蟹 | Mareotis japonicus | + | + | + | |||||||
| 绒螯近方蟹 | Hemigrapsus peniciillatus | + | |||||||||
| 长足长方蟹 | Metaplax longipes | + | + | + | |||||||
| 软体动物 | 珠带拟蟹守螺 | Cerithidea cingulata | + | ||||||||
| 碎屑食者 | 多毛类动物 | 不倒翁虫 | Sternaspis scutata | + | + | + | |||||
| 棘皮动物 | 倍棘蛇尾属 | Amphioplus sp. | + | ||||||||
| 软体动物 | 褐蚶 | Didimacar tenebrica | + | + | |||||||
| 杂食者 | 多毛类动物 | 琥珀刺沙蚕 | Neanthes succinea | + | |||||||
| 软体动物 | 泥螺 | Bullacta exarata | + | + | + | + | |||||
| 其他类动物 | 弹涂鱼 | Periophthalmus novaeguineaensis | + | + | |||||||
| 物种数量/种 | 29 | 6 | 14 | 9 | 8 | 20 | 6 | ||||
注: “+”代表物种在该潮带出现。 |
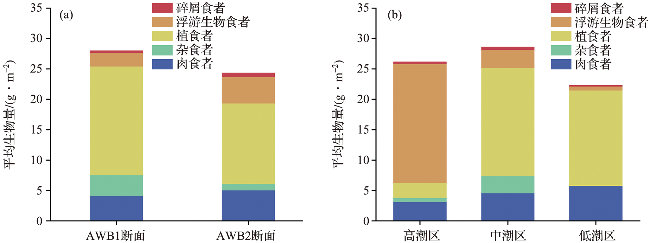
2.2 大型底栖动物功能群组成与生态系统健康程度
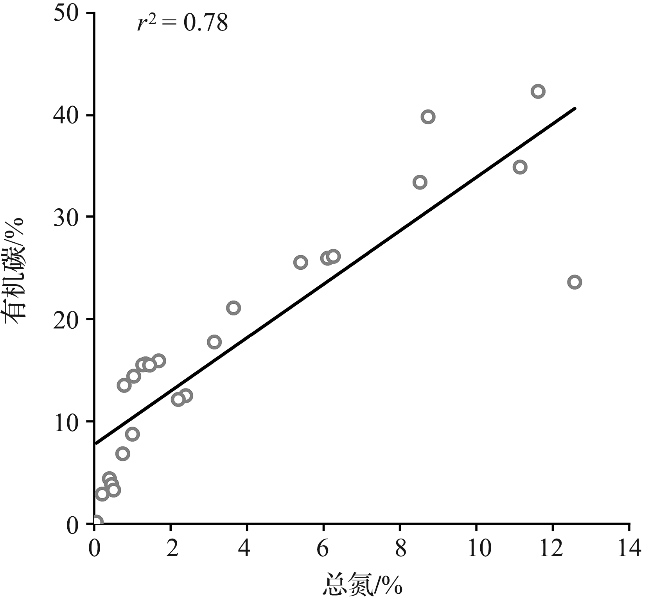
2.3 大型底栖动物生物碳库
表2 隘顽湾不同类群大型底栖动物的有机碳含量Tab.2 Organic carbon content among different taxa of macrobenthos in Aiwan Bay |
| 类群 | 大型底栖动物有机碳含量平均值/% | |
|---|---|---|
| AWB1断面 | AWB2断面 | |
| 甲壳类动物 | 12.30±3.86 | 22.17±4.29 |
| 软体动物 | 4.63±2.12 | 16.88±4.38 |
| 多毛类动物 | 17.49±14.14 | 28.46±4.87 |
| 其他类动物 | 42.19 | 39.71 |
| 棘皮动物 | 15.90 | |
注:表中空白表示无数据。 |
3 讨论
3.1 通过大型底栖动物群落结构评价淤泥质潮滩生境
表3 我国淤泥质潮滩生境大型底栖动物群落结构、丰度、生物量统计Tab.3 Statistics of macrobenthos community structure, abundance and biomass at muddy tidal flat in China |
| 海域 | 调查时间 | 多样性指数H' | 丰富度指数D | 均匀度指数J | 平均丰度/(ind·m-2) | 平均生物量/(g·m-2) | 数据来源 |
|---|---|---|---|---|---|---|---|
| 隘顽湾 | 2021年8月 | 3.18 | 3.29 | 0.72 | 105.2 | 46.9 | 本研究 |
| 南麂 列岛 | 2006年11月 | 1.39 | 1.19 | 0.71 | 51.0 | 6.5 | 文献[34] |
| 2007年4月 | 3.06 | 4.23 | 0.90 | 319.0 | 302.4 | ||
| 2010年2月 | 1.62 | 1.99 | 0.65 | 250.7 | 55.4 | 文献[35] | |
| 2010年8月 | 2.12 | 5.48 | 0.60 | 359.2 | 497.5 | ||
| 崇明东滩 | 2019年8月 | 96.4 | 68.4 | 文献[36] | |||
| 南汇边滩 | 2019年8月 | 160.4 | 45.7 | 文献[36] | |||
| 三门湾 | 2012年8月 | 0.62~1.87 | 2.64~4.32 | 407.3 | 171.9 | 文献[37] | |
| 湄洲湾 | 2010年10月 | 2.32 (0.93~3.18) | 1.84 (1.21~2.63) | 0.79 (0.27~0.97) | 91.0 | 73.9 | 文献[38] |
| 莱州湾 | 2016年7月 | 2.21 | 1.25 | 0.63 | 68.5 | 24.6 | 文献[39] |
| 2016年10月 | 2.39 | 1.20 | 0.71 | 55.1 | 18.2 | ||
| 南黄海 | 2019年8月 | 2.33 | 1.51 | 0.85 | 115.0 | 245.0 | 文献[40] |
| 2019年10月 | 2.01 | 1.22 | 0.81 | 126.0 | 174.5 |
注:表中空白表示无数据。 |
3.2 淤泥质潮滩大型底栖动物的固碳潜力
表4 常见沿海生境中的有机碳含量Tab.4 Organic carbon content in common coastal habitats |
| 生境类型 | 调查深度/cm | 植物有机碳含量/(Mg·hm-2) | 沉积物有机碳含量/(Mg·hm-2) | 数据来源 | |
|---|---|---|---|---|---|
| 地上 | 地下 | ||||
| 红树林 | 100 | 138.0±21.6 | 52.0±8.9 | 307.0±33.2 | 文献[8] |
| 海草 | 0.09±0.03 | 0.07±0.03 | 138.0±8.6 | ||
| 泥滩 | 143.0±15.5 | ||||
| 沙洲 | 124.0±3.1 | ||||
| 红树林 | 50 | 179±82 | 文献[9] | ||
| 红树林边缘 | 68±11 | ||||
| 泥滩 | 62±10 | ||||
| 红树林 | 100 | 253.98 | 83.96 | 344.67±42.23 | 文献[54] |
| 海草 | 0.36 | 0.41 | 175.14±23.81 | ||
| 盐沼植物 | 8.82 | 9.95 | 134.37±19.43 | ||
| 15年红树林 | 100 | 50.98±8.82 | 171.57 | 文献[55] | |
| 45年红树林 | 116.56±13.72 | 274.53 | |||
| 80年红树林 | 289.90±18.33 | 380.72 | |||
| 泥滩 | 111.23 | ||||
| 本土红树林 | 100 | 154.6±27.1 | 69.9±11.6 | 文献[56] | |
| 外来红树林 | 245.2 | 65.1 | |||
| 海三棱藨草 | 100 | 5.6 | 165.1 | 文献[57] | |
| 芦苇 | 29.4 | 165.7 | |||
| 互花米草 | 38.3 | 171.1 | |||
| 泥滩 | 151.2 | ||||
注:表中空白表示无数据。 |