0 引言
1 材料与方法
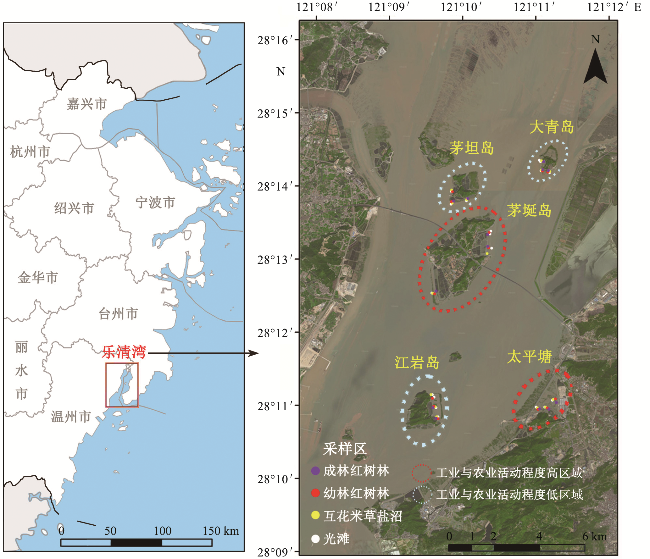
1.1 研究区域
1.2 滨海湿地生境选择与沉积物样品采集
1.3 土壤碳组分测定
1.4 土壤重金属含量测定
1.5 数据统计方法
2 结果
2.1 不同区域和湿地生境的土壤碳组分分布
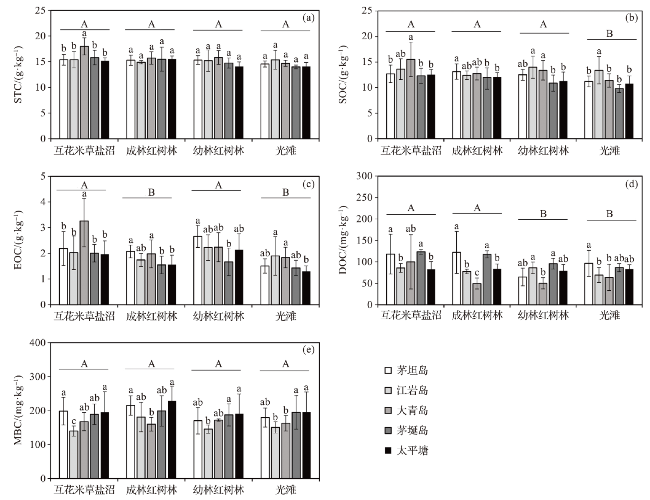
2.1.1 不同区域土壤碳组分的差异
图2 乐清湾不同区域滨海湿地生境土壤碳组分含量及其差异(不同大写字母表示湿地生境类型间差异达到显著性水平,不同小写字母表示不同区域间差异达到显著性水平。) Fig.2 Carbon component contents in the soil of coastal wetland habitats in different regions of Yueqing Bay and their differences (Different capital letters indicate significant differences among wetland habitats, and different lowercase letters indicate significant differences among study areas.) |
2.1.2 不同湿地生境土壤碳组分的差异
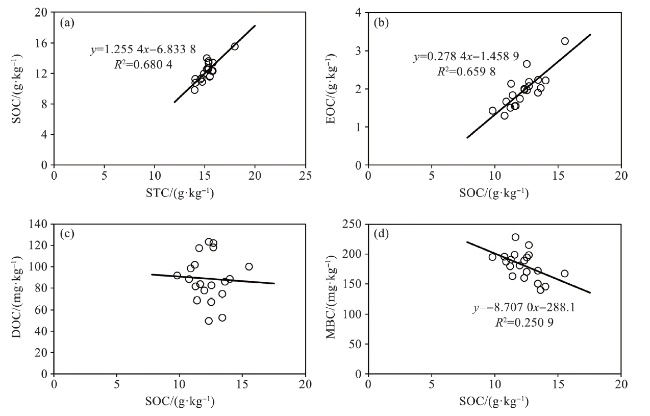
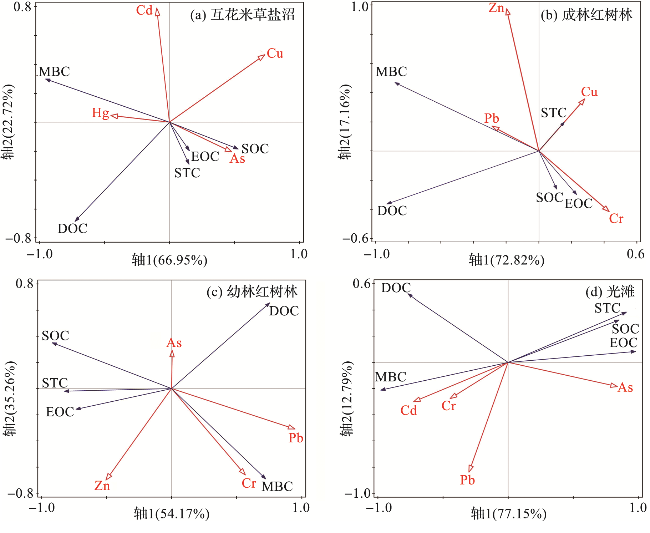
2.1.3 湿地土壤碳组分之间的相关性及环境影响
图3 土壤碳组分间的相关性(综合5个研究区域和4类湿地生境。) Fig.3 Correlations among soil carbon fractions (Integrating 5 study areas and 4 types of wetland habitats.) |
表1 区域和湿地生境对土壤碳组分的主效应与交互作用分析Tab.1 Analysis on main and interactive effects of area and wetland habitat on soil carbon components |
| 主效应/交互作用 | STC | SOC | EOC | DOC | MBC |
|---|---|---|---|---|---|
| 区域 | 2.437ns | 5.024** | 3.374* | 7.692** | 2.167ns |
| 生境类型 | 9.899** | 27.480** | 9.118** | 2.060ns | 1.205ns |
| 区域×生境类型 | 1.243ns | 2.699* | 1.389ns | 1.104ns | 0.521ns |
注:“*”表示显著相关,p<0.05;“**”表示极显著相关,p<0.01;“ns”表示不显著相关,p>0.05。 |
2.2 不同区域和湿地生境的土壤重金属含量分布
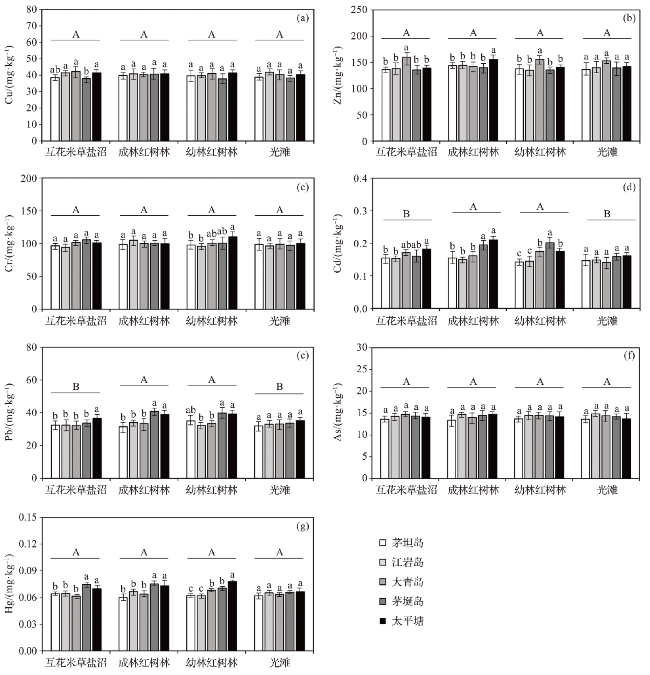
2.2.1 不同区域土壤重金属含量的差异
图4 乐清湾不同区域滨海湿地生境土壤重金属含量及其差异(不同大写字母表示湿地生境类型间差异达到显著性水平,不同小写字母表示不同区域间差异达到显著性水平。) Fig.4 Heavy metal contents in the soil of coastal wetland habitats in different regions of Yueqing Bay and their differences (Different capital letters indicate significant differences among wetland habitats, and different lowercase letters indicate significant differences among study areas.) |
2.2.2 不同湿地生境土壤重金属含量的差异
表2 区域和湿地生境对土壤重金属的主效应与交互作用分析Tab.2 Analysis on main and interactive effects of area and wetland habitat on soil heavy metal content |
| 主效应/交互作用 | Cu | Zn | Cr | Cd | Pb | As | Hg |
|---|---|---|---|---|---|---|---|
| 区域 | 5.814** | 4.722* | 0.693ns | 5.189* | 7.558** | 1.627ns | 5.889** |
| 生境类型 | 0.456ns | 0.507ns | 0.442ns | 2.266ns | 2.762ns | 0.935ns | 0.815ns |
| 区域×生境类型 | 0.139ns | 0.122ns | 0.093ns | 1.005ns | 1.098ns | 0.102ns | 0.140ns |
注:“*”表示显著相关,p<0.05;“**”表示极显著相关,p<0.01;“ns”表示不显著相关,p>0.05。 |