0 引言
1 材料与方法
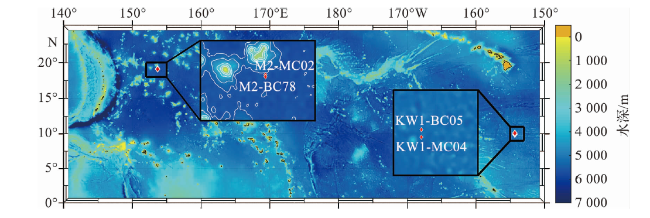
1.1 样品来源
图2 结核样品主要形态与对应薄片的外观(a~d: 西太平洋M2-BC78站位所采结核样品及其对应的薄片;e~h:东太平洋KW1-BC05站位所采结核样品及其对应的薄片。) Fig.2 Main morphologies of nodule samples and the appearance of corresponding thin sections (a-d: Morphologies and corresponding thin sections of nodule samples collected at M2-BC78 site from the western Pacific; e-h: Morphologies and corresponding thin sections of nodule samples collected at KW1-BC05 site from the eastern Pacific.) |
1.2 DNA提取与PCR扩增
1.3 扩增产物纯化与测序
1.4 数据建库与生物信息学分析
1.5 扫描电镜与能谱分析
2 结果与分析
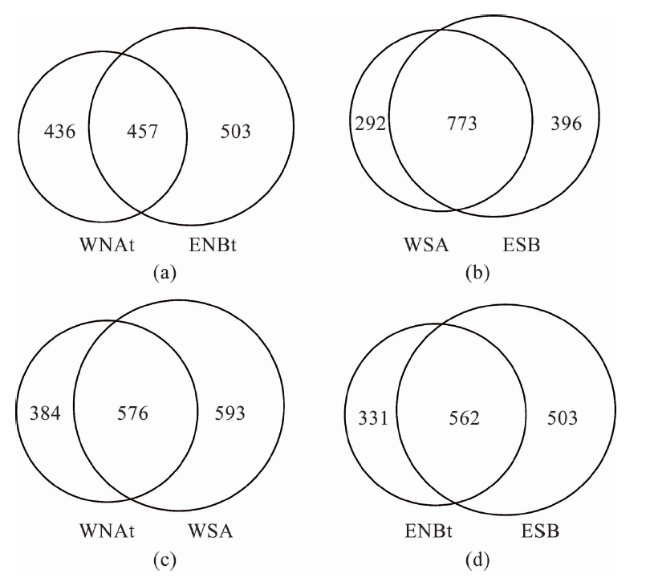
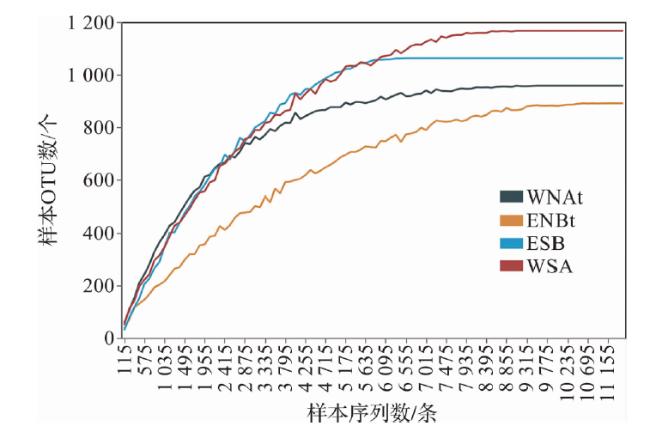
2.1 细菌群落多样性
表1 细菌序列信息与多样性指数Tab.1 Bacterial sequence information and diversity index |
| 项目 | 西太平洋M2-MC02站 | 东太平洋KW1-MC04站 | |||
|---|---|---|---|---|---|
| 结核 (WNAt) | 沉积物 (WSA) | 结核 (ENBt) | 沉积物 (ESB) | ||
| 序列数/条 | 10 319 | 9 535 | 11 553 | 6 862 | |
| OTU数/个 | 960 | 1 169 | 893 | 1 065 | |
| ACE | 1 024 | 1 490 | 1 201 | 1 512 | |
| Shannon指数 | 8.38 | 8.45 | 6.26 | 7.45 | |
| 覆盖率/% | 99 | 99 | 99 | 99 | |
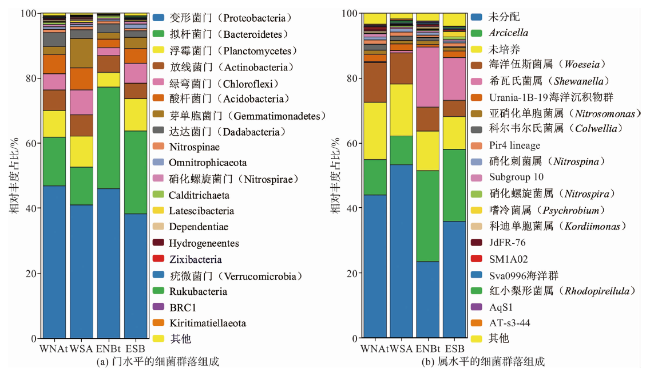
2.2 细菌群落组成
图5 东、西太平洋结核和沉积物中的细菌群落组成(“未分配”代表无法明确分类到已知属的序列集合,“未培养”代表无法通过传统培养方法从环境中培养的属集合。) Fig.5 Bacterial community composition in nodules and sediments of the eastern and western Pacific Ocean (“unassigned” represents a collection of sequences that cannot be definitively classified into known genera, “uncultured” represents a collection of genera that cannot be cultivated from the environment using traditional cultivation methods.) |
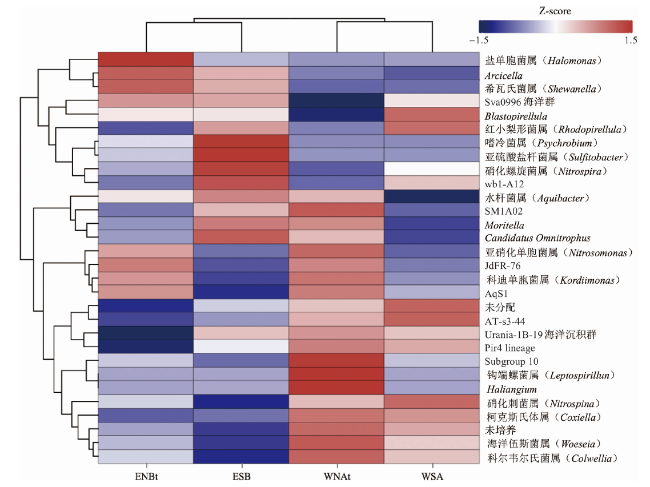
图6 属水平(前30位)物种相对丰度平均聚类热图(图中颜色代表属在样品中的富集程度,颜色越红表示富集程度越大;“未分配”代表无法明确分类到已知属的序列集合,“未培养”代表无法通过传统培养方法从环境中培养的属集合。) Fig.6 Relative abundance average clustering heatmap at the genus level (top 30) (The color in the figure signifies the degree of enrichment of the genus within the sample, with deeper red hues indicating a higher level of enrichment. “unassigned” represents a collection of sequences that cannot be definitively classified into known genera, “uncultured” represents a collection of genera that cannot be cultivated from the environment using traditional cultivation methods.) |
2.3 结核内部构造
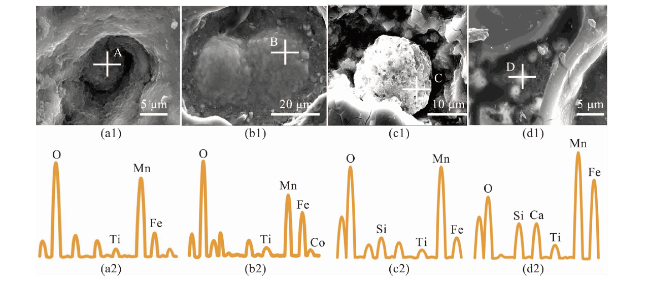
图8 结核内微球结构及对应点位的能量色散光谱(EDS)结果(a~b:西太平洋结核中的微球结构和EDS结果;c~d:东太平洋结核中的微球结构和EDS结果。) Fig.8 Microsphere structures in the nodules and corresponding energy dispersive spectroscopy results (a-b: Microsphere structures and corresponding EDS results in the western Pacific nodules; c-d: Microsphere structures and corresponding EDS results in the eastern Pacific nodules.) |